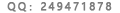中国消费者报讯(记者万晓东)中国消费者报连续报道的“美敦力”人工心脏瓣膜疑似黑户事件有了新进展。近日,福州市市场监督管理局正式向福建医科大学附属协和医院(以下简称福建协和),送达了榕市场监管执罚字(2016)2-11号行政处罚决定书,认定该医院使用未依法注册医疗器械,对该医院处以1313万余元罚款。
(这究竟是咋回事呢?让小编细细讲述这幕后的维权故事)
母亲术后死亡 她发现所换生物瓣膜与手术记录不同
2013年9月18日,福建消费者沈秀娣在福建省协和医院做“主动脉瓣生物瓣置换术”,更换生物瓣膜后次日死亡。
“福建省协和医院的医生为我母亲更换生物瓣膜后,我母亲血压很低,血液体外循环机无法脱机。在没有征求家属同意的情况下,医生为我母亲做了心脏搭桥手术,之后血液体外循环机还是无法脱机,医生未经家属同意拆下已经安装的生物瓣膜,换上国产GKS机械瓣膜。手术体外循环近7小时,我母亲心肌严重受损,一下手术台医生就下了病危通知书。术后第二天,我母亲就宣告死亡。”沈秀娣的女儿黄女士说,“出院时,我们打出收费清单发现,生物瓣膜并没有收费,我们意识到是不是生物瓣膜出现问题导致我母亲的死亡。手术记录和病程记录均记载我母亲使用的是‘爱德华’生物瓣膜。我们要求医院提供该生物瓣膜的合格证、说明书、标签等相关信息资料。2014年6月,医院提供了生物瓣膜追溯标签,标签显示,我母亲使用的并非‘爱德华’瓣膜,而是‘美敦力’生物瓣膜。”
拿到医院提供的贴在“医院使用登记簿”上的“美敦力”生物瓣膜追溯标签的复印件后,黄女士一头雾水。“没有中文说明、注册证号、产品标准号、生产日期、失效日期、生产企业、生产地址等重要信息,怎么算作追溯标签?出现问题怎么追溯?”黄女士说,“《医疗器械说明书、标签和包装标示管理规定》要求,标签上文字内容必须使用中文,而且上述信息应当在标签上明示。医疗器械的产品名称应当清晰地标明在说明书、标签和包装标识的显著位置,并与医疗器械注册证书中的产品名称一致。”
经过努力,黄女士得到了更多关于美敦力瓣膜的材料,发现了更多的问题。“医院提供的使用环节追溯标签上的产品名称(英文)为‘HANCOCKIIPORCINEHEARTVALVE’,产品外包装上印刷标示的产品名称(英文)为‘HANCOCKIIT505CINCHII’,都与医院提供相对应的注册证‘国食药监械(进)字2010第3461137号’(以下简称137号注册证)上的产品名称(英文)‘HancockIIPorcineBioprosthesis’不一致。医院提供的产品说明书封面上的中文名称为‘生物瓣膜’,与137号注册证上的中文名称‘人工心脏瓣膜’不一致。”
另外,黄女士发现美敦力最新申报注册时所提供备案的中文《使用说明书》出现多处错误。黄女士说,第一处说明书表述“轻轻握住人工心脏瓣膜缝合环开启手柄棘齿装置,沿顺时针方向旋转(图8)”,而图8内容为“不旋转CINCH手柄”;第二处说明书表述“用剪刀或手术刀断掉3根夹套缝线,取出夹套(图9)”,而图9内容为“充分旋转CINCH手柄”;第三处说明书表述“植入时将绿色缝线标记朝向右纤维三角(图10)”,而图10内容为“旋紧CINCH手柄”。说明书表述中只有图1—图10有操作说明,而后面的附图却有14个,说明书没有对图11-图14的操作进行文字描述。
黄女士表示,“出现几个不同英文、中文名称,让消费者没办法追溯产品信息。另外,医生要根据使用说明书进行操作,说明书出现多处图文不对应问题,会导致操作失误,酿成大祸。作为国际大公司特别是医疗器械公司,怎么能够出现这么低级的错误”。
该款瓣膜涉嫌未获准注册
黄女士说,“混乱的产品名称让我无法追查产品情况,我四处了解情况走了很多弯路,直到有知情者提醒我应查看一下产品有没有经过国家注册”。
黄女士注意到,在其母亲使用的美敦力瓣膜外包装照片中,有“T505C221”字样。黄女士向国家食药监总局申请信息公开。2015年12月15日、今年4月18日,国家食药监总局两次向黄女士下发《政府信息公开告知书》,其中“食药监政信函(2016)324号”告知黄女士,“国食药监械(进)字 2010第3461137号注册证产品规格型号信息为‘T505、T510’。注册产品标准信息表明,型号T505、T510包含‘T50521H……’共25个,注册 证 及 注 册 产 品 标 准 中 无T505C221。”同时,该告知书写明,按照国家规定“未获准注册的医疗器械,不得销售、使用”。
国家食药监总局还向黄女士提供了一份137号注册证办理时,备案的美国FDA(美国食品药品管理局FoodandDrugAdministration简称FDA)出具的编号为1702-1-2009的《致外国政府的证书》,该证书是原产国上市批准和出口证明文件。该证书标明,“上述产品此时可在美国上市,并且可从美国合法出口到外国”,查询证书得知,没有T505C221的描述。
黄女士说,“与T505C221同系列 的 还 有 T505C223、T505C225、T505C227、T505C229,5组数字在137号注册证和《致外国政府的证书》上都没有,所以我认为,这5组数字对应的瓣膜在137号注册证办理时,美国是不允许出口到国外,在中国也没有进行过注册,是不能够在中国销售和使用的。”
图:国家食药监总局给黄女士下发的信息公开告知书。
涉案产品补充注册难补“黑户”之嫌
拿到《政府信息公开告知书》后,在与国家食药监总局工作人员沟通中,黄女士偶然得知,2014年12月29日美敦力对15个产品进行了注册,注册产品由25个变为15个,其中包括了T505C221等5个产品。
黄女士立即再次申请信息公开。《政府信息公开告知书》向黄女士出具了“国械注进20143466140号”注册证、美敦力人工心脏瓣膜说明书、美国FDA出具的编号6810-11-2012《给外国政府的证书》,上述3个材料中均出现了T505C221、T505C223、T505C225、T505C227、T505C229的描述。
黄女士认为,“这5组数字对应的产品在2010年注册时肯定没有注册,否则美敦力不会在2014年年底进行申报注册。”
“T505C221”等5组数字到底是什么?记者向美敦力(上海)管理有限公司询问。该公司回复称,“产品标签显示,T505C221等均为产品编号的字符描述,并非产品型号的字符描述”。
T505C221等数字是产品编号还是型号规格?有何意义?黄女士就此咨询了国家食药监总局,并进行了录音。黄女士问,“企业说T505C221是产品编号,这不需要审批吗?”工作人员答,“产品编号、货号等都是识别标识,应该归到型号里面。除了每个产品一个的序列号不需要报批外,其他都需要向国家食药监总局报批。国家食药监总局给你回复20103461137注册证中没有T505C221的描述,就是企业没有报批,就可以说是无注册证的产品”。
近日,记者跟随黄女士来到国家食药监总局医疗器械技术审评中心。该中心一位工作人员表示,“医疗器械审批非常严格,137号注册证的注册产品标准信息表明T505、T510包含25个产品,就是说T505、T510是大的系列,包含25个产品规格,无论叫规格还是编号都对应相应产品,超出这25个就不是该注册证批准注册的产品。”
随后,记者询问美敦力(上海)管理有限公司“T505C221、T505C223、T505C225、T505C227、T505C229”型号产品,何时被食药监部门允许进口和使用的?所进口和使用的数量分别是多少?该公司以该5组数字是产品编号为由,没有答复。
“手术结束后,瓣膜外包装被丢弃,患者只能看到贴在病历上的产品追溯标签,而标签信息不全,产品名称存在多个版本,让患者如何维权?”黄女士不无担忧地说,“137号注册证是2010年5月7日批准的,距国械注进20143466140号注册证批准有长达4年多的时间,未经注册的5组数字对应的产品有多少中国患者使用了?还有没有其他未经注册的瓣膜产品或其他产品销售使用?再往前追溯,2010年之前这些产品是不是就已经在销售?消费者希望国家食药监部门从源头入手,对此事进行彻底调查。”
福州市场监管局立案调查
今年1月14日,福州市市场监管局根据消费者黄建华的投诉举报,就福建医科大学附属协和医院涉嫌使用无注册证医疗器械人工心脏瓣膜案立案调查。4月底,该局一行4人来到国家食药监总局,了解相关情况并递交了《关于外包装标示为REF(产品编号)T505C221、REF(产品编号)T505C223的进口医疗器械人工心脏瓣膜等产品如何认定的请示》(榕市场监管稽2016236号)。6月初,福州市市场监管局接到国家食药监总局医疗器械注册管理司《关于进口医疗器械人工心脏瓣膜有关标示情况的函》(食药监械管便函(2016)35号),该函明确,“国食药监械(进)字2010第3461137号的产品注册标准YZB/USA0557-2010《人工心脏瓣膜》的3.2项中‘产品规格’‘产品编号’‘产品号’等多种叙述实际载明的内容均为产品规格。”
“国家食药监总局已经认定,《产品注册标准》中的产品编号是产品规格,那么就可以确定‘T505C221、T505C223、T505C225、T505C227、T505C229、T505CF21’就是6款产品的产品规格,而不是美敦力强调的产品编号。否则,美敦力是否可以提供6个产品编号对应的产品规格呢?”曾长期参与卫生部立法工作的北京中医药大学卫生法学教授卓小勤表示,“医疗器械的产品规格就像产品的名字,是产品注册的最基本项目,产品规格不在《产品注册标准》里,自然就是未注册产品。美敦力公司在产品注册时把简单的产品规格,描述成‘产品规格’‘产品编号’‘产品号’等多种称谓,本身就是在玩文字游戏。”
卓小勤说,“医疗器械要在国内上市,必须经过国家食药监部门的注册,特别是三类植入性医疗器械的注册很复杂,需要对产品进行全方位审评,对材料进行严格审查,方可通过注册。一款植入性医疗器械的注册用时可能有1年到1年半。注册的严格审核正是为了严控产品质量,未经注册的产品,可能没有经过国家食药监部门的检测和临床实验认可安全有效性”。
经查,福建协和于2010年至2015年间,从上海幕士医疗器械有限公司购进,并在手术中为病患使用标称注册证号为国食药监械(进)字2010第3461137号的,美敦力公司生产的规格为T505C221、T505C223、T505C225的“人工心脏瓣膜”共计79个产品,均为未依法注册医疗器械,货值1544890元。
经过数月调查,7月8日,福州市市场监管局向福建协和送达了《行政处罚告知书》。7月12日,福建协和向福州市市场监管局申请听证。
7月听证 院方提出已过追溯时效
7月22日,福建省福州市市场监督管理局就拟查处福建省医科大学附属协和医院使用涉嫌未依法注册的医疗器械人工心脏瓣膜案举行听证会。
据悉,此次听证会根据福建协和的申请组织召开。该案件主办协办人员、福建协和、患者家属在听证会上就相关事项做了陈述和申辩。利害关系人设备生产商美敦力(上海)管理有限公司和代理商上海慕士医疗器械有限公司未参加听证会。
福州市市场监管局主办协办人员介绍案件的调查情况时称,根据举报,该局从2014年开始介入调查,2016年1月10日立案。根据医疗器械分类管理目录,‘人工心脏瓣膜’属于第三类植入性器械,对人体有潜在的危险,需要严格监管。按照国家规定,涉案产品在中国注册时,必须提供境外上市证明。美敦力公司在2010年注册137号注册证时,提供的境外上市证明中没有‘T505C221、T505C223、T505C225、T505C227、T505C229’信息。所以,认定上述产品均不属于137号注册证的产品,属于无医疗器械注册证的产品。另外,2016年4月18日,国家食药监总局食药监政信函(2016)324号政府信息公开明确,关于137号注册证所包含的规格型号有25种,该注册证及注册标准中无T505C221。所以,认定事实清楚、证据确凿。
福建协和委托律师发表申辩意见称,首先,医院使用的医疗器械是依法注册的医疗器械,并已经取得医疗器械注册证,注册证号为137号。同时,医院已经查验经营许可证、营业执照,核对了注册证,注册证号、产品型号、生产者名称、产品标准编号等有关法定文件,履行了法定义务。另外,医院是根据上级卫生行政部门指示,通过集中采购程序,合法采购的入围品种目录表中列明的该涉案医疗器械。其次,此次福州市场监管局处罚的产品涉及到的2010年和2011年所使用的产品,目前已经超过法律规定的追溯时效。因此,协和医院认为福州市场监管局的拟处罚结论于法无据。
患者家属黄建华表示,已有来自国家食药监总局和美国食品药物管理局等权威部门的多项证据,证明涉案医疗器械并非福建协和和美敦力公司所说的不是‘产品编号’,而是“规格型号”。同时,来自国家食药监总局和美国食品药物管理局等权威部门的证据也表明,涉案的美敦力人工心脏瓣膜产品未经国家食药监部门注册。
据介绍,福州市场监管局办案人员将根据福建协和提出的异议进行补充调查,待调查结束后,将正式做出案件结论。
开出巨额罚单 患者维权才起步
福州市市场监管局经过研究认为,根据国家食药监总局政府信息公开告知书,2010年的医疗器械注册证国食药监械(进)字2010第3461137号所列明的产品规格共25个,不包含T505C221、T505C223、T505C225。2014年的医疗器械注册证国械注进20143466140号,才批准T505C221、T505C223、T505C225的人工心脏瓣膜的注册。因此,涉案的人工心脏瓣膜属未经依法注册的医疗器械,福建协和关于涉案产品为合法注册的医疗器械说法不成立。
福建协和从2010年至2015年连续购进、使用未经依法注册的人工心脏瓣膜,根据《行政处罚法》第二十九条第二款“违法行为有连续或者继续状态的,从行为终了之日起计算”的规定,福建协和购进并使用的涉案79个人工心脏瓣膜均在法定应被处罚的时效内。因此,协和医院的部分产品处罚超过了法定时效的说法不成立。
协和医院使用79个未经依法注册的医疗器械的行为,违反了《医疗器械监督管理条例》第四十条的规定,且涉案产品为植入性高风险医疗器械,属于从重情形,根据《医疗器械监督管理条例》第六十六条第一款第(三)项规定,责令当事人立即改正上述违法行为并给予以下行政处罚:处货值金额1544890元8.5倍罚款,共计13131565元。
医院虽被开巨额罚单,但患者的权益如何保护呢?中国消费者报将对此事件继续跟踪报道。
作者:本报记者 万晓东
依据中国消费者报报5月30日1版《这款人工心脏瓣膜是不是黑户》、6月17日1版《又一款心脏瓣膜疑似黑户》、7月29日1版《福建协和涉嫌使用未注册医疗器械案听证》中国消费网9月13日《“美敦力”心脏瓣膜未注册 福建协和被罚千万元》编辑。